叶酸受体双抗ADC新药CBP-1008的临床研究正在招募中
关于CBP-1008:CBP-1008基于BESTTM平台开发的首个双配体耦联药物!
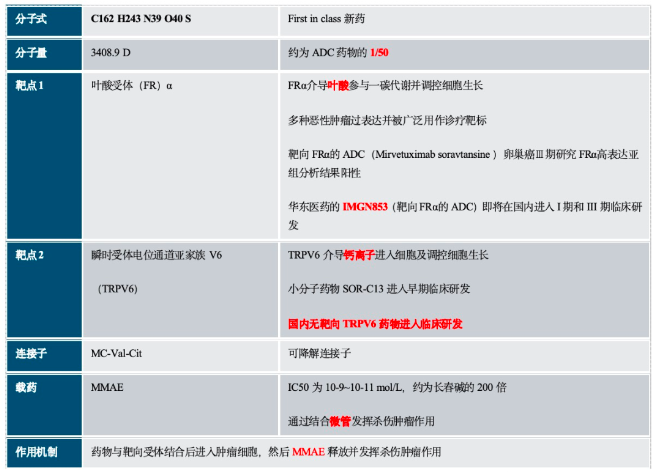
MMAE在靶向作用下,进入肿瘤细胞和微管结合,干扰微管功能,使细胞周期停滞在G2/M期,最终导致细胞凋亡。
药效特点:
1.组织穿透性高;
2.双靶点协同效应高;
3.与PD-1联用增效性;
4.抗肿瘤广谱性。
入选标准(仅当符合下列所有标准时,受试者才有资格入选本研究):
1. 签署知情同意书(ICF)时为18 至70 岁(含边界)。
2. 预期生存期>12 周。
3. Ⅰa 期:无标准治疗或标准治疗失败或无法耐受的晚期恶性实体瘤患者;
4. Ⅰb 期:
队列1:铂耐药卵巢癌、输卵管癌或原发性腹膜癌。铂耐药定义为患者含铂类治疗中进展或最后一次含铂类药物给药后<6 个月发生疾病进展或复发。
队列2:转移性三阴性乳腺癌
基于最近的活检或其他病理标本,组织学确诊为TNBC;
不可切除的局部晚期或转移性乳腺癌,局部晚期或转移阶段接受1 线以上系统化疗,且存在治疗失败证据,包括影像学进展和毒性不耐受等;
既往有紫杉类药物治疗史,且存在紫杉类药物治疗失败证据,包括影像学进展和毒性不耐受等。
队列3:无标准治疗或标准治疗失败或无法耐受现有治疗的其他晚期实体瘤患者,包括:食管鳞癌、乳腺癌(非TNBC 类型)、头颈部鳞癌、肺鳞癌、胃腺癌、结肠癌、宫颈癌、子宫内膜癌等,申办方将根据疗效决定某些肿瘤类型是否继续入组或终止,其他肿瘤类型的入组需获得申办方同意。(目前队列3可以筛:乳腺癌(非TNBC类型)、胆管癌、食管癌、胰腺癌、子宫内膜癌)
5. ECOG 评分为0-1。
6. 按照RECIST 1.1 版,至少有1 个可测量的病灶。
7. 可提供存档的肿瘤组织样本(活检或手术取出,为福尔马林固定石蜡包埋的组织[6~10个预切未染色的切片]),或新鲜肿瘤活检样本(Ⅰa期患者不强制要求提供,Ⅰb期患者要求提供);若存档组织切片不够,且研究者评估新鲜组织活检可行且安全,应当在首次给药前进行新鲜肿瘤组织活检。
8. FOLR1 和/或TRPV6 受体表达经中心实验室检测为阳性。
9. 既往抗肿瘤疗法的末次给药距离本研究CBP-1008 的首次给药至少达到28 天。开始用试验药物之前的28 天内未使用过其他试验药物或试验性器械或参加其他临床试验。
10.根据NCI-CTCAE 4.03(Ⅰa期)或5.0版(Ⅰb期),任何既往疗法、手术或放射疗法的急性毒性必须已缓解至0或1级(除外:脱发,或色素沉着或放疗引起的远期毒性,经研究者判断不能恢复)。
11. 充分的骨髓功能(入组前2 周内未接受输血和生长因子的情况下),定义为:
a) 中性粒细胞(ANC)≥1.5×109/L;
b) 血小板计数≥90×109/L。
c) 血红蛋白≥100 g/L。
12. 充分的肝功能, 定义为血清总胆红素≤ 1.5×ULN、天冬氨酸氨基转移酶(AST)和丙氨酸氨基转移酶(ALT)≤2.5×ULN。(对于合并有肝转移的患者,天冬氨酸氨基转移酶(AST)和丙氨酸氨基转移酶(ALT)≤3×ULN)。
13. 充分的肾功能,定义为血清肌酐<实验室正常参考范围上限,或肌酐清除率≥ 50 mL/min/1.73m2(计算公式见附录11)。
14. INR 和APTT ≤ 1.5 × ULN, 仅适用于未接受抗凝治疗的受试者;接受抗凝治疗受试者应采用稳定剂量
15. 适当的血清钙浓度,若血钙低于正常值且患者存在低蛋白血症,则参考血清白蛋白校正钙浓度≥1×正常值下限(LLN)且≤2.9 mmol/L(11.5 mg/dL)。
注:筛选期血清钙测定前,至少8 小时内不得应用钙补充剂:校正钙浓度计算公式为,校正钙浓度(mg/dL)=血钙测量值(mg/dL)+0.8×[4−白蛋白 (g/dL)],若白蛋白浓度≥4.0 g/dL,校正钙浓度等于血钙测量值(mg/dL)。初测时血清钙浓度的测量值不在上述规定范围内的受试者允许复测,复测后钙浓度在规定范围内的受试者可以继续参加筛选。
16. 充分的心脏功能,定义为左心室射血分数≥50%或机构的正常值下限;QTc-F≤ 450 ms。
17. 男性或女性
a) 男性受试者:
男性受试者需要满足绝育(生物学或手术方式)或承诺在研究期间及末次给药后7 天内使用本方案附录5 中详述的节育方法。
b) 女性受试者:
女性受试者的合格条件为:不是附录5 中定义的育龄期女性(WOCBP),或承诺在治疗期间和CBP-1008 末次给药后7 天内遵循附录5 中的避孕指南的WOCBP。
育龄期女性(WOCBP)在CBP-1008 首次给药前7 天内的妊娠测试需为阴性。
18. 提供已签署的ICF,并愿意遵守方案中所有的研究程序和规则。
患者受益:
⭐可抢先获得国际前沿新药使用机会,对晚期肿瘤患者来说可能是新的生机;
⭐入组后相关的检查、治疗、用药均为免费,大大减轻家庭经济负担!
⭐大型三甲医院一线专家团队为你的治疗保驾护航!
注:做了基因检测的病友可以拿出报告看看,一旦存在突变,可以扫描下方二维码添加专员看看是否有机会接受国内新药治疗,看不懂的病友也可以添加专员解读报告。也可加入“阳光易家亲–肿瘤患友群”或者相应的靶点患友群,与上万位肿瘤患友/家属分享经验,互通有无。




 浙公网安备 33010602004553号
浙公网安备 33010602004553号


