2024年元旦后第一个工作日(1月2日),国内肿瘤患者迎来多个好消息,三款抗肿瘤药物获得国家药品监督管理局(NMPA)批准分别用于乳腺癌、肝癌、肺癌。
获批情况:
1.帕妥珠曲妥珠单抗注射液(皮下注射)用于治疗早期和转移性HER2阳性乳腺癌患者;
2.PD-1抑制剂替雷利珠单抗用于一线治疗不可切除或转移性肝细胞癌(HCC)患者;
3.PD-1抑制剂特瑞普利单抗联合化疗围手术期以及单药辅助治疗用于可切除III期非小细胞肺癌(NSCLC)患者。
5-8分钟完成给药,曲妥珠/帕妥珠单抗组合为乳腺癌患者带来更便捷治疗选择
1月2日,中国国家药监局(NMPA)官网最新公示,罗氏(Roche)递交的帕妥珠曲妥珠单抗注射液(皮下注射)新药上市申请已正式获批。公开资料显示,这是一款固定剂量组合的皮下制剂(商品名为Phesgo),此前已在美国、欧盟等国家和地区获批,用于治疗早期和转移性HER2阳性乳腺癌患者。与标准静脉给药的数小时相比,Phesgo可在5~8分钟内将帕妥珠单抗和曲妥珠单抗以更快的方式完成给药。
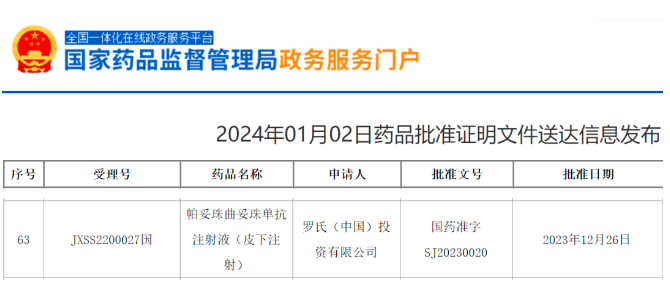
截图来源:NMPA官网
Phesgo是一款包含帕妥珠单抗、曲妥珠单抗与透明质酸酶的皮下注射固定剂量组合。其中,帕妥珠单抗(商品名:Perjeta/帕捷特)和曲妥珠单抗(商品名:Herceptin/赫赛汀)均为罗氏开发的靶向HER2的单克隆抗体,它们均与HER2受体结合,但位置不同,两者联合用药被认为可对HER信号通路提供更全面的双重阻断。
另外,Phesgo还使用了Halozyme Therapeutics公司的Enhanze给药技术,该技术基于其专有的重组人透明质酸酶PH20(rHuPH20),该酶可暂时降解人体内的透明质酸,从而有助于其他注射治疗药物的分散和吸收。
FeDeriCa III期研究结果显示,与标准静脉输注帕妥珠单抗相比,帕妥珠曲妥珠单抗皮下给药的血药浓度在设定的注射周期间隔内达到非劣的主要终点,几何平均比值(GMR;评估药代动力学时使用的一种平均值)为1.22(90%CI:1.14-1.31),GMR=1.14的90%CI下限≥0.80(预先指定的非劣效性界限)。研究也达到了次要终点,即皮下制剂治疗的患者血药浓度不劣于静脉注射曲妥珠单抗。此外,皮下制剂联合化疗与静脉注射帕妥珠单抗、曲妥珠单抗联合化疗的安全性相当,未发现新的安全信号。
乳腺癌是全球最常见的癌症之一,大约五分之一的乳腺癌病例被认为是人类表皮生长因子受体2(HER2)阳性。HER2是一种酪氨酸激酶受体促生长蛋白,表达于乳腺癌、胃癌、肺癌、结直肠癌等多种类型的肿瘤表面,HER2蛋白过度表达可能是HER2基因扩增的结果,常与乳腺癌的侵袭性疾病和不良预后有关。
替雷利珠单抗获批第12项适应证!晚期HCC患者添新选择
1月2日,中国国家药监局(NMPA)官网最新公示,百济神州抗PD-1抗体替雷利珠单抗(商品名:百泽安)的新适应症上市申请已正式获批。根据百济神州早前公开资料,此次是替雷利珠单抗在中国获批的第12项适应症,用于一线治疗不可切除或转移性肝细胞癌(HCC)患者。

截图来源:NMPA官网
替雷利珠单抗是一款人源化IgG4抗程序性死亡受体-1(PD-1)单克隆抗体,设计目的旨在最大限度地减少与巨噬细胞中的Fcγ受体结合,帮助人体免疫细胞检测和对抗肿瘤。临床前数据表明,巨噬细胞中的Fcγ受体结合之后会激活抗体依赖细胞介导杀伤T细胞,从而降低了抗PD-1抗体的抗肿瘤活性。
此前,替雷利珠单抗已在中国获批11项适应症,涵盖非小细胞肺癌(NSCLC)、经典型霍奇金淋巴瘤、尿路上皮癌、肝细胞癌、食管鳞状细胞癌、鼻咽癌、胃或胃食管结合部(G/GEJ)腺癌等瘤种,其中包括附条件批准用于治疗至少经过一种全身治疗的肝细胞癌。在海外,该产品的新药上市许可申请还获得了美国FDA和欧洲药品管理局(EMA)受理。
此次替雷利珠单抗获批肝细胞癌一线治疗适应症,是基于RATIONALE 301的临床试验数据。该临床试验共入组674例患者,其结果以最新突破口头报告的形式公布于2022年欧洲肿瘤内科学会(ESMO)大会。这是一项随机、开放性的全球3期临床研究,旨在评估替雷利珠单抗对比索拉非尼作为不可切除的肝细胞癌成人患者一线治疗的效果。
根据2023年美国临床肿瘤学会(ASCO)年会上公布的研究结果,一项针对RATIONALE 301试验风险因素分析显示,在生物标志物ALBI为1级的亚组中,接受替雷利珠单抗治疗的患者中位总生存期(OS)在数值上比接受索拉非尼治疗的患者更长(19.9个月 vs 16.9个月),在PLR ≤ 141亚组(19.4个月 vs 14.5个月)和NLR ≤ 3亚组(20.9个月 vs 15.2个月)中也观察到同样的趋势,表明其潜在的预后价值。
RATIONALE 301试验的欧洲/北美(EU/NA)亚组分析中,与索拉非尼相比,接受替雷利珠单抗治疗的患者的中位OS、中位缓解持续时间和客观缓解率(ORR)在数值上均更高。与RATIONALE 301研究的原始人群相比,这一欧洲/北美亚组中非病毒性病因的患者比例较高,而晚期疾病患者的数量略少。此外,在欧洲/北美亚组中,与索拉非尼相比,替雷利珠单抗治疗组的≥ 3级治疗中出现的不良事件(TEAEs;46% vs 66%)、≥ 3级治疗相关不良事件(TRAEs;17% vs 50%)和导致治疗终止的TRAE(9% vs 15%)发生率均较低,该趋势与总体研究人群相似。
肝细胞癌是最主要的原发性肝癌,在所有原发性肝脏恶性肿瘤中占比约90%。由于症状显露迟缓,多达80%的肝细胞癌在确诊后会发展成为不可手术切除的转移性癌症。绝大多数肝细胞癌患者都伴有潜在肝硬化症状,需要同时治疗恶性肿瘤与肝硬化,因此肝细胞癌是一种复杂难治的疾病。
单药联合化疗方案获批,非小细胞肺癌围术期治疗再添新药
1月2日,君实生物(1877.HK,688180.SH)宣布,由公司自主研发的抗PD-1单抗药物特瑞普利单抗注射液(拓益®)联合化疗围手术期治疗,继之本品单药作为辅助治疗,用于可切除IIIA-IIIB期非小细胞肺癌(NSCLC)的成人患者的新适应症上市申请于近日获得国家药品监督管理局(NMPA)批准。这是特瑞普利单抗在中国获批的第七项适应症,也是我国首个、全球第二个获批的肺癌围手术期疗法。
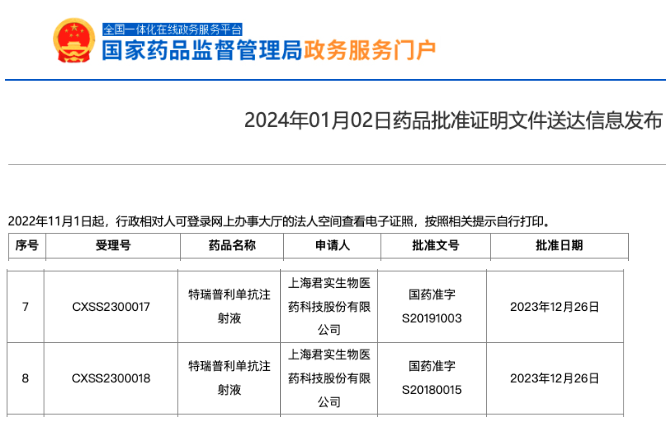
截图来源:NMPA官网
此次新适应症的获批主要基于NEOTORCH研究(NCT04158440)的数据结果。NEOTORCH是一项随机、双盲、安慰剂对照、多中心的Ⅲ期临床研究,由上海交通大学医学院附属胸科医院陆舜教授担任主要研究者,在全国56家中心开展,是全球首个抗PD-1单抗用于NSCLC围手术期(涵盖新辅助和辅助)治疗达到无事件生存期(EFS)阳性结果的Ⅲ期临床研究。
该研究共纳入404例IIIA-IIIB期NSCLC患者,以1:1的比例被随机分配至特瑞普利单抗联合化疗组(n=202)或安慰剂联合化疗组(n=202),分别接受特瑞普利单抗或安慰剂联合化疗术前3周期及术后1周期治疗(鳞癌患者化疗方案为紫杉类+铂类,非鳞癌患者化疗方案为培美曲塞+铂类),随后接受特瑞普利单抗或安慰剂辅助治疗13周期。
此前,NEOTORCH在2023年美国临床肿瘤学会(ASCO)全体大会系列4月会议以及ASCO年会上以口头报告形式公布了最新研究成果。研究数据显示,相较单纯化疗,特瑞普利单抗联合化疗用于可切除III期NSCLC围手术期治疗可显著延长患者的EFS(研究者评估的中位EFS分别为:尚未达到 vs 15.1个月,P<0.0001),将患者的疾病复发、进展或死亡风险降低了60%(HR=0.40,95%CI:0.277-0.565),且不论PD-L1表达状态、组织学类型(鳞状或非鳞状)如何,所有关键亚组中均观察到特瑞普利单抗组的EFS获益。特瑞普利单抗组的主要病理缓解(MPR)率和完全病理缓解(pCR)率明显更优,分别为48.5% vs 8.4%(P<0.0001)和24.8% vs 1.0%(P<0.0001),特瑞普利单抗组的总生存期(OS)也显示出明显的获益趋势。安全性方面,两组治疗期间出现的不良事件(TEAE)发生率相似,未观察到新的安全性信号。
肺癌是目前全球发病率第二、死亡率第一的恶性肿瘤。据统计,2020年中国的肺癌病例数占新发癌症病例数的17.9%(81.6万),癌症死亡病例数的23.8%(71.5万)。NSCLC为肺癌的主要亚型,约占所有病例的85%。其中,20-25%的患者初诊时可手术切除,但即便接受了根治性手术治疗,仍有30-55%的患者会在术后发生复发并死亡。根治性手术联合化疗是预防疾病复发的手段之一,但化疗作为术前新辅助或术后辅助治疗的临床获益有限,仅能将患者的5年生存率提高约5%。
END
希望这些新适应症的获批,能为更多的肿瘤患者带来新的治疗选择和获益。
肿瘤患友如想第一时间了解新药资讯、医保信息、慈善赠药政策等相关内容,可添加下方二维码获取。也欢迎加入“阳光易家亲–肿瘤患友群”,与上万位肿瘤患友/家属分享经验,互通有无。

参考来源:即刻药闻、君实生物、医学界肿瘤频道
文章用于科普宣教,如有侵权请联系删除。



 浙公网安备 33010602004553号
浙公网安备 33010602004553号


