11月13日,中国国家药监局(NMPA)官网最新公示,阿斯利康(AstraZeneca)PD-L1抑制剂度伐利尤单抗(durvalumab,商品名:英飞凡,Imfinzi)的新适应症申请已在中国获批。根据阿斯利康2023年发布的Q1财报,推测该产品本次获批适应症为胆道癌(BTC)。此前,度伐利尤单抗已在中国获批治疗非小细胞肺癌(NSCLC)和广泛期小细胞肺癌的一线治疗。
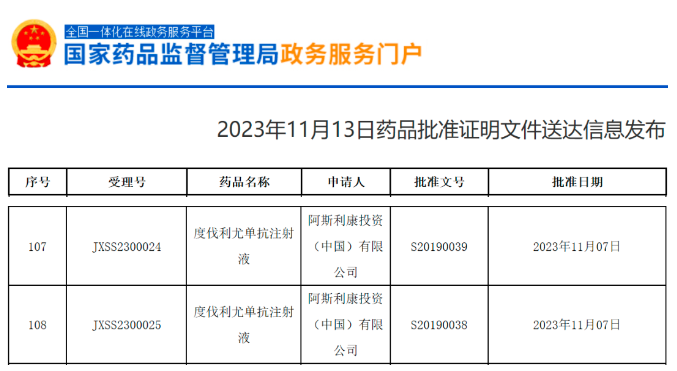
截图来源:NMPA官网
胆道癌(BTC)是一组罕见的侵袭性消化道(GI)肿瘤,形成于胆管(胆管癌)、胆囊或壶腹(胆管和胰管连接到小肠的地方)的细胞中。这些患者的预后很差,患者的五年生存率大约只有5%到15%。影响胆管和胆囊的早期BTC通常没有明显的症状,因此大多数BTC新发病例在晚期才被诊断,而此时治疗选择有限且预后较差。
度伐利尤单抗是一款人源化的抗PD-L1单克隆抗体,能够阻断PD-L1与PD-1和CD80的结合,从而阻断肿瘤免疫逃逸并恢复被抑制的免疫反应。该药目前在多个国家被批准用于治疗多种肿瘤类型,包括广泛期小细胞肺癌(ES-SCLC),既往经治的晚期膀胱癌患者以及联合化疗(吉西他滨加顺铂)治疗局部晚期或转移性BTC等。

此次上市是基于TOPAZ-1研究结果。TOPAZ-1是一项随机、双盲、安慰剂对照、全球多中心的3期临床试验,共纳入685例组织学证实的局部晚期不可切除或转移性胆道癌患者,这些患者此前未接受过晚期疾病的全身治疗。
试验人口统计数据如下:56%亚洲人,37%白人,2%黑人,4%其他种族;7%西班牙裔或拉丁裔;男性和女性各占50%;年龄中位数为64岁,年龄范围在20-85岁之间,47%的人年龄在65岁及以上;56%为肝内胆管癌,25%为胆囊癌,19%为肝外胆管癌。
主要终点是总生存期(OS)。前24周每6周进行一次肿瘤评估,然后每8周进行一次,直到确认客观疾病进展。与随机接受安慰剂联合吉西他滨+顺铂的患者相比,随机接受Durvalumab联合吉西他滨+顺铂的患者的OS有统计学上显著的改善,与安慰剂相比,Durvalumab联合化疗降低了20%的死亡风险(随访延长至6.5个月,死亡风险降低了24%)。Durvalumab组和安慰剂组的总生存期(OS)分别为12.8个月和11.5个月;无进展生存期(PFS)分别是7.2个月和5.7个月;客观缓解率(ORR)分别为27%和19%。
安全性方面,20%的患者会出现常见的不良反应,包括:疲劳、恶心、便秘、食欲下降、腹痛、皮疹和发热。
基于TOPAZ-1的结果,Durvalumab胆道癌适应症在欧洲、日本和其他几个国家的监管申请目前也在审查中。
就在昨日刚获批胆道癌适应症后,今日相关的慈善赠药通道也同步开启,这对胆道癌患者来说无疑是一个惊喜。

援助人群:
持有中华人民共和国居民身份证/军官证的大陆患者。
符合度伐利尤单抗注射液(英飞凡®️) 胆道癌获批适应症。
援助方案:
1.低保患者(确诊为胆道癌之前就持有低保证)
经项目医生评估,经基金会审核通过后,在病情无进展并持续获益的前提下,可为其援助直至疾病进展。
2.低收入患者(确认符合灾难性医疗支出的患者)
第一阶段自行使用度伐利尤单抗注射液(英飞凡®️)累计达到3000毫克后可按周期使用剂量获得最多不超过18000毫克的药品援助,且本阶段累计总用药时长不超过12个月;
第二阶段自行使用度伐利尤单抗注射液(英飞凡®️)累计达到1500毫克后可按周期使用剂量获得最多不超过9000毫克的药品援助,且本阶段累计总用药时长不超过6个月;
在病情无进展并持续获益的前提下,可按第二阶段的援助模式进行循环申请。
肿瘤患友若想咨询相关的慈善赠药渠道、价格等,可添加下方的二维码找到我。也可加入“肿瘤病友群”,与上万位肿瘤患友/家属分享经验,互通有无。




 浙公网安备 33010602004553号
浙公网安备 33010602004553号


