说起仿制药,我们的第一印象就是“印度仿药”、“孟加拉仿药”…这些药的渠道不透明,也无法保证药效和真伪,只能把自己当做小白鼠,去试药,是大家常规理解中的“假药”。但其实,在国内这些仿制药是国家大力认可并且支持发展的,且合法合规。
就在近期,第三批国家鼓励仿制药品目录发布了!国家卫健委药物政策与基本药物制度司发布《关于第三批鼓励仿制药品建议目录的公示》内容显示,为落实国务院办公厅《关于改革完善仿制药供应保障及使用政策的意见》有关制定仿制药品目录的部署和要求,2023年,国家卫生健康委、工业和信息化部、国家医保局和国家药品监管局、国家知识产权局等部门组织专家对国内专利即将到期尚未提出注册申请及临床供应短缺(竞争不充分)的药品进行遴选论证,提出了《第三批鼓励仿制药品建议目录》。
小编也整理了肿瘤相关的药品,大家看看有自己的原研品种吗?
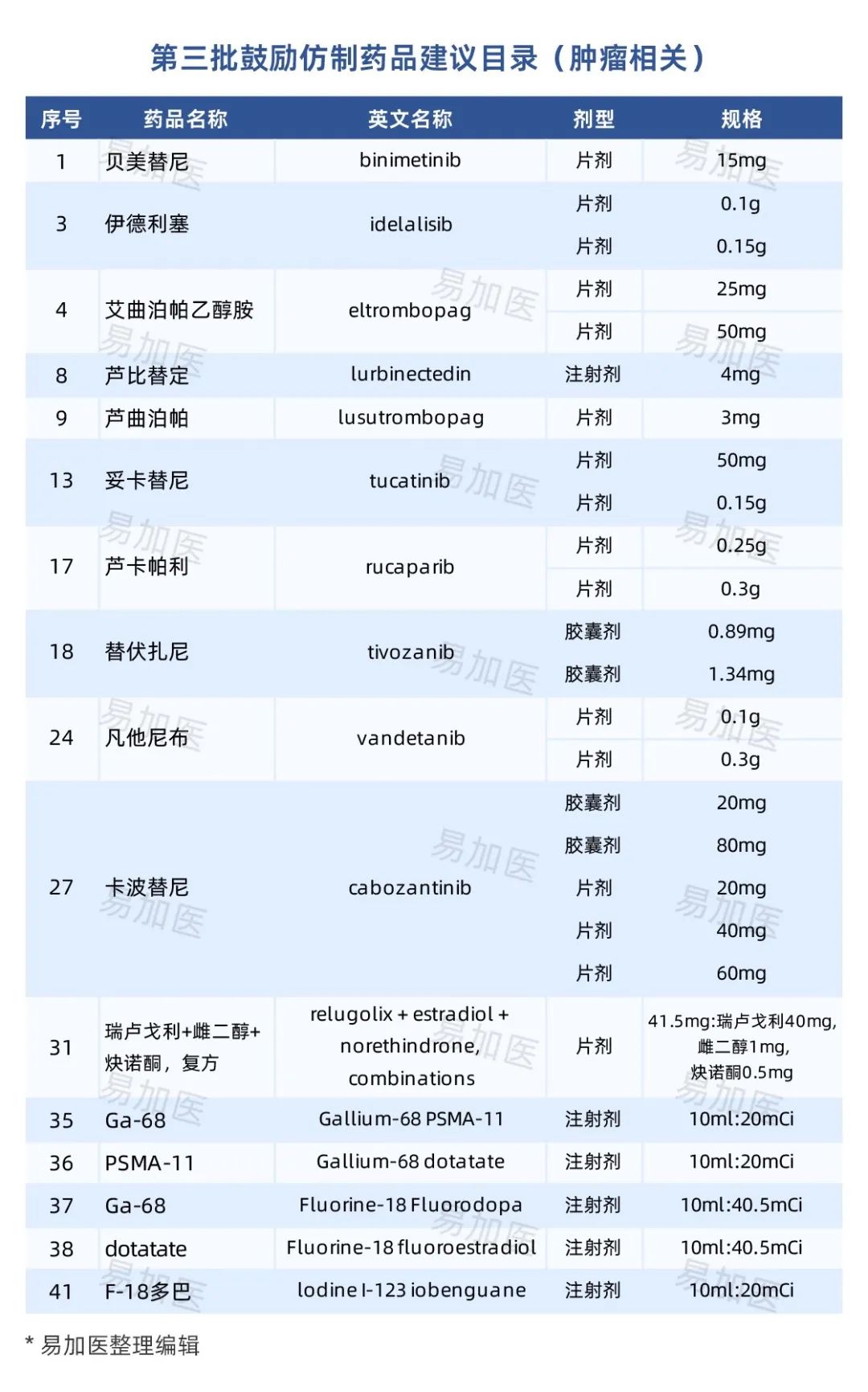
期待这些药物能够尽快的上市,惠及更多的肿瘤患者。
常见问题答疑
01 什么是仿制药?
仿制药是指与原研药具有相同活性成分、剂型、给药途径和治疗作用的药品。
原研药一般是有发明专利的原创性新药,研发难度高,从研发到上市,一般耗时十数年,资金投入巨大。
02 什么是仿制药一致性评价?
为了使仿制药在质量和疗效上达到与原研药一致的水平,我国政府要求对仿制药开展一致性评价。
03 仿制药一致性评价有哪些研发环节?
首先是药学研究,需要对仿制药和原研药的处方、质量标准、晶型、粒度和杂质等主要药学指标进行比较研究,以及固体制剂溶出曲线的比较研究,初步确认仿制药与原研药的质量一致性。
通常还要进行生物等效性研究,需要通过临床试验考察在相同试验条件下仿制药和原研药在人体内的吸收程度和吸收速度的差异,这需要对服用原研药和仿制药的受试者进行血液等生物样本的采集,并检测生物样本中的药物浓度。
04 仿制药一致性评价标识
药盒上的仿制药一致性评价标识是仿制药在质量和疗效上的保证,代表仿制药完成了一致性评价研究,并经过了药监部门严格的审查审批,大家看到这个标识就可以放心够买和使用仿制药啦。
如您希望第一时间获取新药相关资讯,也可加入“肿瘤病友群”,与上万位肿瘤患友/家属分享经验,互通有无。
文章用于科普宣教,如有侵权请联系删除。



 浙公网安备 33010602004553号
浙公网安备 33010602004553号


