7月19日,阿斯利康(AstraZeneca)和第一三共(Daiichi Sankyo)宣布,双方联合开发的抗体偶联药物(ADC)Enhertu(trastuzumab deruxtecan)在欧盟获得批准一项新适应症,作为单一疗法用于治疗既往接受过一种或多种基于抗HER2方案治疗的不可切除或转移性HER2阳性乳腺癌成年患者。

今年5月,该药已经获得美国FDA批准二线治疗乳腺癌。
根据新闻稿,该药本次在欧盟的获批是基于3期临床试验DESTINY-Breast03的结果,该试验的研究对象是既往接受过曲妥珠单抗和紫杉烷治疗的HER2阳性不可切除和/或转移性乳腺癌患者。试验数据显示,与曲妥珠单抗(T-DM1)相比,Enhertu将患者的疾病进展或死亡风险降低了72%。该试验结果已在《新英格兰医学杂志》上发表。
关于DESTINY-Breast03研究
DESTINY-Breast03研究是首个头对头对比ADC药物(DS-8201和T-DM1)治疗HER2阳性晚期乳腺癌疗效与安全性的一项多中心、开放性、随机、Ⅲ期主动对照研究(NCT03529110),纳入了先前在晚期或转移性环境中接受过曲妥珠单抗(赫赛汀)和紫杉类治疗的不可切除或转移性 HER2 阳性乳腺癌患者524例。值得注意的是,这些患者被允许具有临床稳定的、经治疗的脑转移。
中期分析结果显示,研究达到了无进展生存期 (PFS) 的主要终点,与T-DM1相比,DS-8201将患者的疾病进展或死亡风险降低72%。HER2阳性MBC患者的中位随访时间在实验组为15.5个月(范围,15.1-16.6),在对照组为13.9个月(范围,11.8-15.1)。根据BICR评估,与对照组的6.8个月(95%CI,5.6-8.2)相比,实验组的中位PFS未达到(95%CI,18.5至不可评估[NE])(HR,0.28;95%CI,0.22-0.37;P = 7.8 x 10-22)。BICR的12个月PFS率在DS-8201组为75.8%(95%CI,69.8%-80.7%),而在T-DM1组为34.1%(95%CI,27.7%-40.5%)。
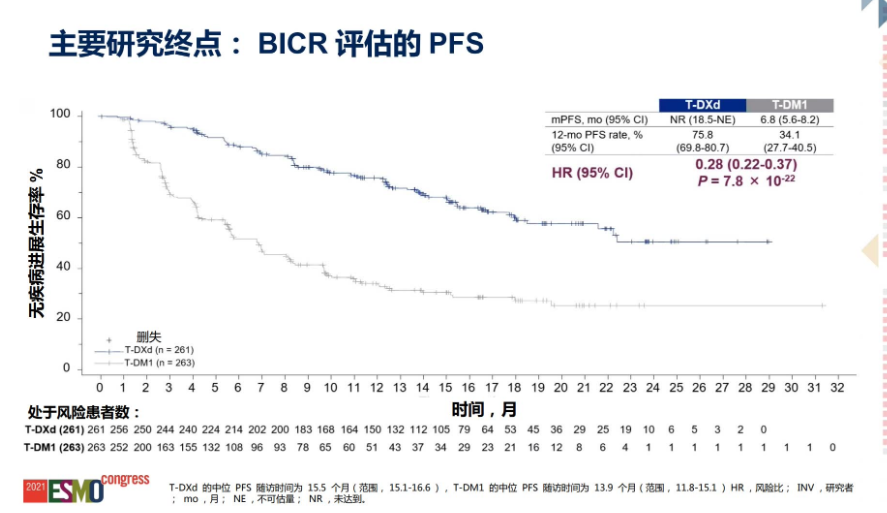
DESTINY-Breast03的其它研究结果还表明,在次要终点总生存期(OS)方面,Enhertu表现出了改善OS的现象(HR=0.55),但该分析尚未成熟,进一步的分析正在进行中。此外,几乎所有接受Enhertu治疗的患者(96.1%)在9个月时依然存活,而接受曲妥珠单抗治疗的患者为91.3%。在客观缓解率(ORR)方面,与曲妥珠单抗组相比,Enhertu组增加了一倍以上(79.7% vs 34.2%)。
基于DESTINY-Breast03的结果,在2021年10月更新的欧洲医学肿瘤学会(ESMO)临床实践指南中,已推荐使用Enhertu作为接受过紫杉烷和曲妥珠单抗治疗后进展的HER2阳性转移性乳腺癌患者的首选二线治疗方案。
作为下一代ADC改良的标杆,DS-8201已在多种肿瘤中体现了其卓越的治疗实力。期待这款重磅疗法能够为更多的患者造福。
肿瘤患友若希望在第一时间获得关于DS-8201的上市价格、临床招募、慈善赠药政策等资讯,欢迎添加下方二维码咨询。也可加入“阳光易家亲–肿瘤患友群”,与上万位肿瘤患友/家属分享经验,互通有无。



 浙公网安备 33010602004553号
浙公网安备 33010602004553号


