“化疗化疗,一化就了”,这种说法不仅流传在不少癌症患者之间,甚至很多癌症相关的影视剧里都会见到。虽然如今化疗药也不断发展,这老话的确有夸大之嫌,但也无法否认多数化疗药物,还是避免不了有着恶心、呕吐、脱发、食欲不振、贫血等副作用。
这些副作用可能严重影响患者的正常生活,也会让患者的身心同时受到煎熬,所以不少患者真的是“谈化疗而色变”,对于医生提出的化疗方案,总是会很紧张很害怕。
其实,治疗癌症一方面要追求更好的疗效,一方面也要让治疗对患者“更友好”,而这些年非常火的免疫治疗,就有可能同时实现这两个目标,比如已经登陆中国好几年,帮助了很多癌友们的纳武利尤单抗(欧狄沃,O药)等PD-1抑制剂。
纳武利尤单抗的好搭档——靶向CTLA-4的免疫疗法伊匹木单抗(逸沃,“Y药”)也已经登陆了中国,组成“O+Y”的双免疫联合方案,首先用于恶性胸膜间皮瘤的一线治疗。其实,这对“无化疗”黄金搭档已经在多个癌种的临床试验中打败化疗,能让不少癌症患者真正实现“无化疗”的治疗,疗效也能更上一层楼。
CTLA-4和PD-1,诺奖各分一半
虽然进入中国相对更晚一些,但伊匹木单抗靶向的CTLA-4这个靶点,其实被科学家们发现得更早,Y药也是真正意义上的全球首个免疫治疗药物。
CTLA-4是一种位于人体免疫细胞主力——T细胞表面的分子,之所以叫它“免疫检查点”,是因为它起到的是限制T细胞活性的作用:人体在遭遇外来病原体,或者是检出癌细胞时,会有专门的一群细胞作为“传令兵”,将这些外敌的分子特征传达到淋巴结,从而激活初始T细胞,让T细胞动员起来准备作战;而在激活到一定程度之后,初始T细胞就会表达CTLA-4,不让T细胞的活性太强,伤及正常的组织和细胞。
在正常情况下,CTLA-4的限制作用能够让人体的免疫系统相对稳定,不大开杀戒滥杀无辜,但如果是要对抗癌症,那T细胞活性越强才越好,CTLA-4就成了碍事的绊脚石。用药物抑制它的作用,就能给人体强大的免疫系统“松绑”,让它们去杀伤癌细胞。
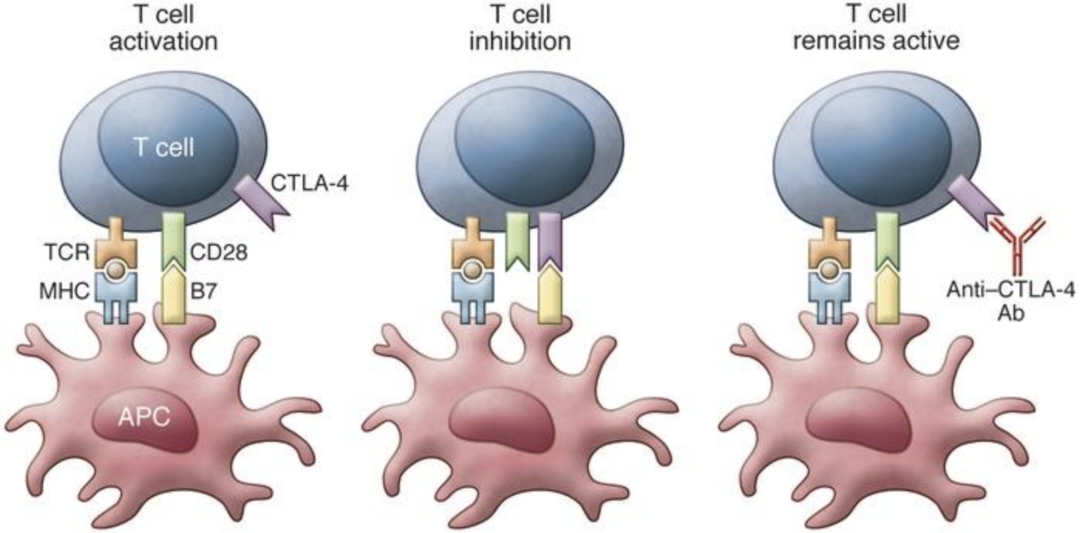
CTLA-4抑制剂可重新激活“休眠”的T细胞
1996年美国科学家James Allison及团队首次在实验中证实,用抗体药物抑制CTLA-4,能够增强抗肿瘤免疫应答[1],此后又经历了十多年的艰辛发展,才有了伊匹木单抗在2011年获批,用于晚期黑色素瘤的治疗。
而纳武利尤单抗靶向的免疫检查点PD-1,发现要比CTLA-4稍晚一些,作用的原理也不相同。CTLA-4是限制T细胞的激活,在淋巴结处产生作用;而PD-1是在T细胞已经被激活之后,主要到肿瘤所在的部位起效:T细胞表面的PD-1与其它细胞表面的PD-L1结合后,T细胞就知道对面的细胞不是敌人,从而不会再杀伤对方,免疫功能就被限制住了。
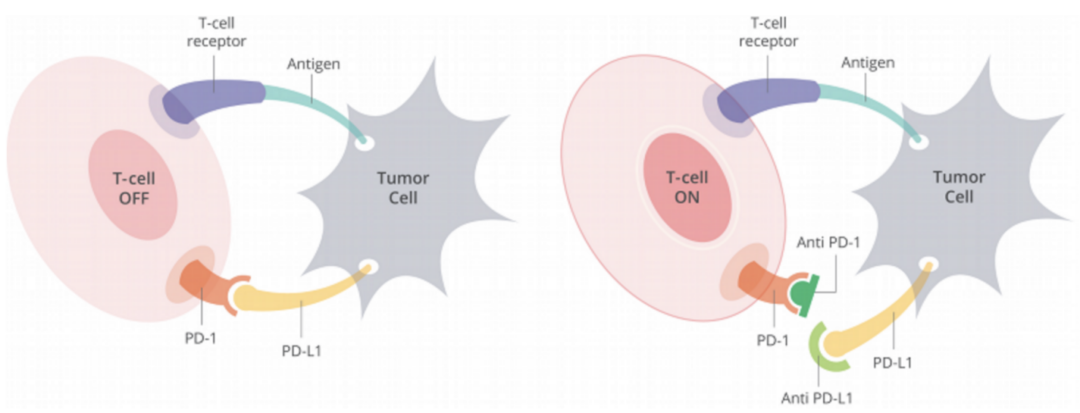
PD-1抑制剂可解除肿瘤细胞对T细胞的“伪装”
人体大多数正常细胞以及免疫细胞都能够表达PD-L1,从而向免疫细胞表明自己不是敌人,但狡猾的癌细胞同样也会表达PD-L1,而如果T细胞没能察觉真相,癌细胞就能溜之大吉,因此抑制PD-1或者PD-L1,切断它们之间的结合,就能重新激活免疫功能。
最早发现PD-1这个位点的是日本科学家本庶佑,在免疫治疗的发展过程中,James Allison和本庶佑都功不可没,因此分别代表着CTLA-4抑制剂与PD-1抑制剂的两位科学家,也分享了2018年的诺贝尔生理学或医学奖。
O+Y实现“1+1>2”
Y药和O药单独使用时,都能激活一部分癌症患者体内的免疫系统,从而杀伤肿瘤、延长患者的生存期,但两种药物联合使用,更是能够“珠联璧合”,进一步提高治疗效果,这也让O+Y方案“诺奖组合”的外号,更加名副其实了。
前面也提到过,CTLA-4和PD-1这两个免疫检查点的作用部位、作用时间、作用方式都不相同,所以CTLA-4抑制剂与PD-1抑制剂同时使用,不仅不会给对方添乱,反而经一系列的研究证实,两者还能“协同增效”。
首先,使用CTLA-4抑制剂,能让更多的效应T细胞、记忆T细胞被激活,从淋巴结移动到肿瘤所在的部位,而在这里PD-1抑制剂可以再解除T细胞身上的PD-1这层束缚,真正释放T细胞对肿瘤的杀伤力[2]。
如果要打个比方,CTLA-4抑制剂就好比“后勤保障部队”,能帮助源源不断地“训练”出具有抗肿瘤战斗力的激活T细胞,送往前线作战;PD-1抑制剂则好比 “前线指挥”,指挥T细胞识破癌细胞伪装,两者一前一后,默契配合,持续杀伤肿瘤。
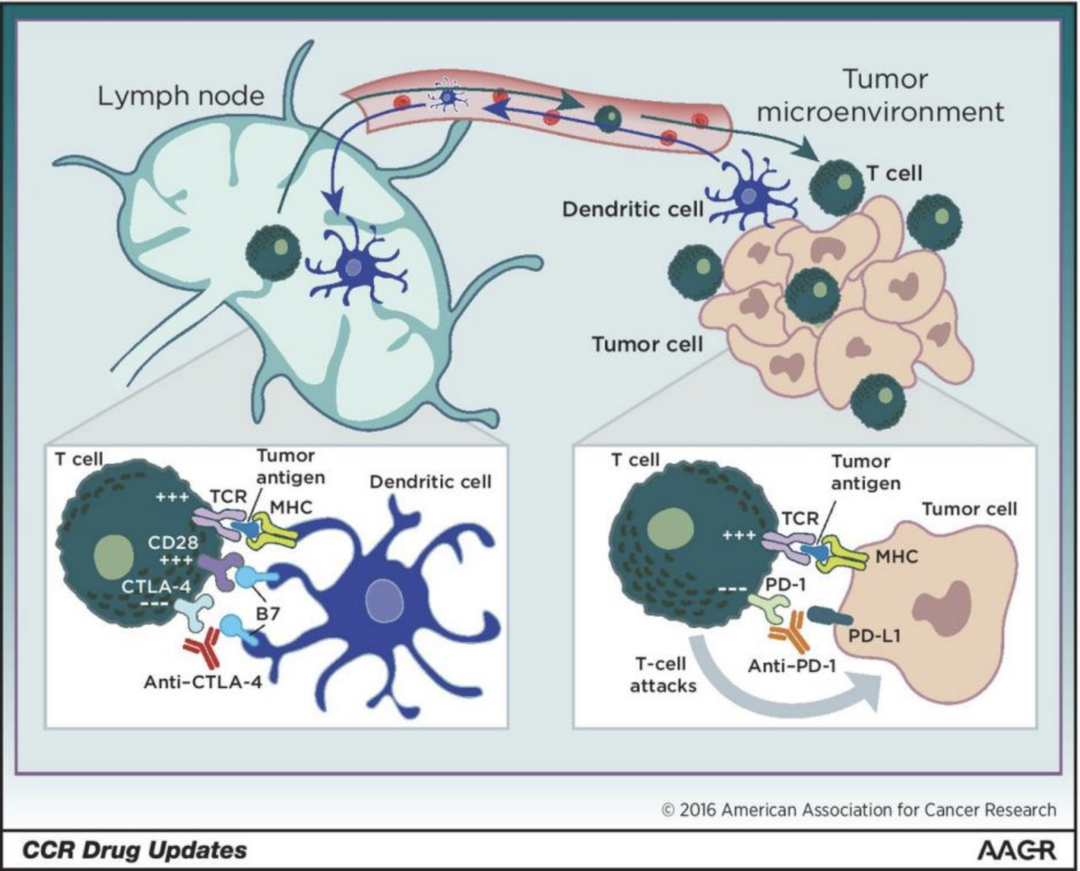
CTLA-4抑制剂与PD-1抑制剂的协同效应
此外,美国德州大学MD安德森癌症中心的科学家们还发现,CTLA-4抑制剂与PD-1抑制剂可谓“同出一门,各成一派“,两者通过不同方式影响T细胞来启动抗癌免疫攻击,因此两者联合使用会比单个使用更为有效[2]。
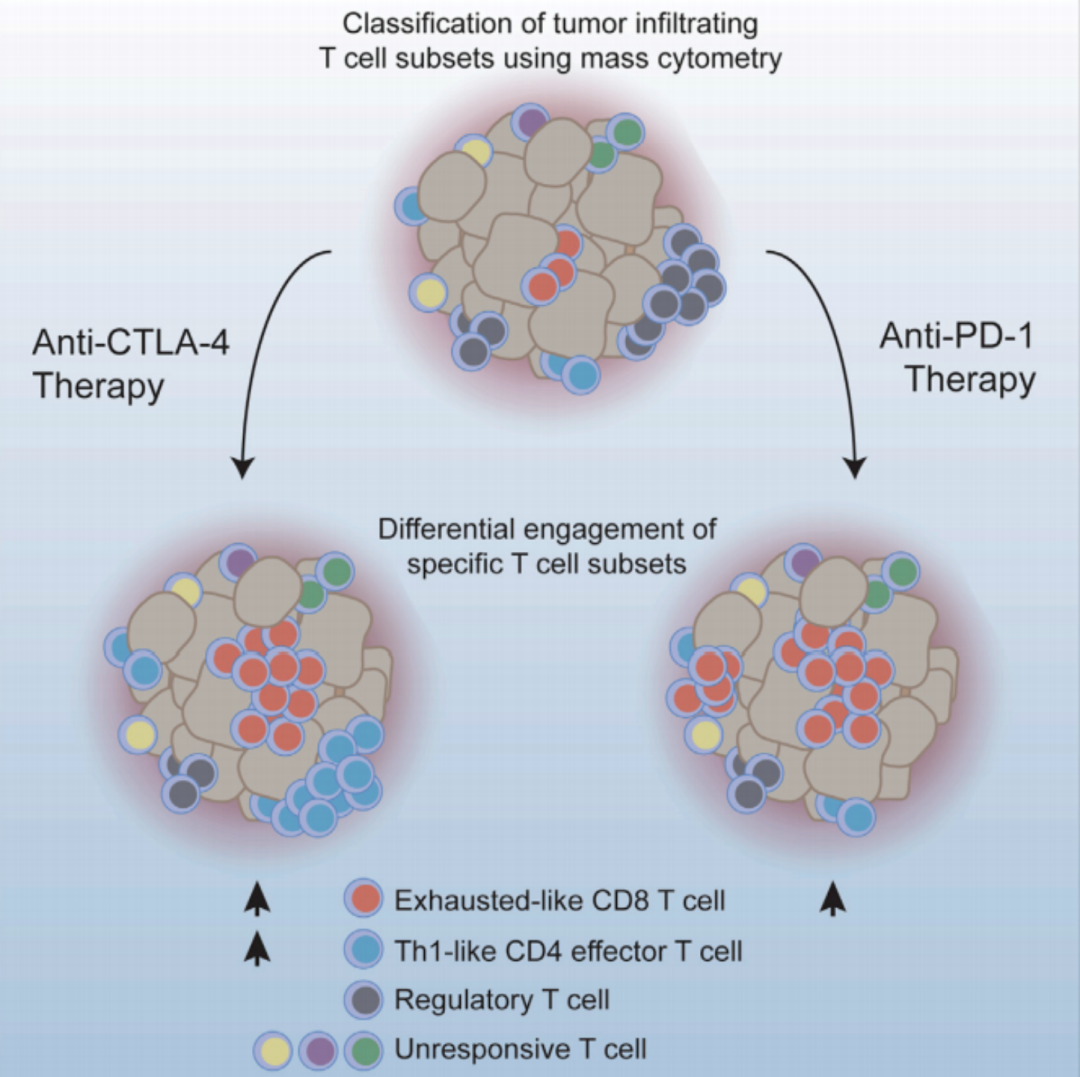
CTLA-4抑制剂与PD-1抑制剂影响不同类型的T细胞
事实上,近年来O+Y组合一系列临床试验的成功,也证实了科学家们在实验室里由各个层面分析获得的发现:O+Y,确实能够1+1>2。当然,目前我们对于免疫检查点抑制剂的认知、应用与把控,还远不够深入,如何才能更好的应用其特色助力实现“全效抗击“癌细胞,未来还有更长的路要走。
能治6种癌症,生存、缓解显著延长
目前O+Y方案已经在全球获批治疗6种癌症,包括黑色素瘤、肾细胞癌、肝细胞癌、结直肠癌、非小细胞肺癌、胸膜间皮瘤,基本无需联合化疗,能够真正实现“无化疗”抗击晚期癌症。在中国,O+Y方案已在今年年中获批用于恶性胸膜间皮瘤患者的一线治疗。
和标准的化疗对比,O+Y方案主要优势可以体现在两个方面:
一是生存期显著更长。晚期肿瘤一线治疗的首要任务是延长患者生命,因此总生存期是评价药物疗效最重要的指标之一。
二是缓解时间大大延长。恶性肿瘤往往进展很快,而更长的缓解就意味着患者能享受更长的疾病不进展时间,生活质量就不会因肿瘤发展而持续下降,也是非常有意义的。
不过,谈到Y药,大家最关心的还是安全性问题。随着研究者对免疫治疗的学习的深入,近年来多个癌种越来越多的临床研究数据显示,O+Y方案的安全性普遍可控,与化疗相比并没有导致更多的副作用。
事实上,免疫治疗的常见副作用与化疗也不一样,主要为腹泻和皮疹等。化疗常见的如恶心、呕吐、脱发、中性粒细胞减少等这些让患者较难接受的副作用,在使用免疫治疗时明显更少[3] [4]。
相信未来,O+Y的“无化疗”联合疗法将会为更多癌症患者带来新的治疗选择,为抗癌争取多一分胜算。
— 参考来源 —
1. Leach D R, Krummel M F, Allison J P. Enhancement of antitumor immunity by CTLA-4 blockade[J]. Science, 1996, 271(5256): 1734-1736.
2. Spencer C. Wei, Jacob H. Levine, Alexandria P. Cogdill et al. Distinct Cellular Mechanisms Underlie Anti-CTLA-4 and Anti-PD-1 Checkpoint Blockade. Distinct Cellular Mechanisms Underlie Anti-CTLA-4 and Anti-PD-1 Checkpoint Blockade. Cell, Published online: 10 August 2017, doi:10.1016/j.cell.2017.07.024
3. Baas P, Scherpereel A, Nowak A K, et al. First-line nivolumab plus ipilimumab in unresectable malignant pleural mesothelioma (CheckMate 743): a multicentre, randomised, open-label, phase 3 trial[J]. The Lancet, 2021, 397(10272): 375-386.
4. Hellmann M D, Paz-Ares L, Bernabe Caro R, et al. Nivolumab plus ipilimumab in advanced non–small-cell lung cancer[J]. New England Journal of Medicine, 2019, 381(21): 2020-2031.



 浙公网安备 33010602004553号
浙公网安备 33010602004553号


