12月9日,国家药品监督管理局官网显示,阿斯利康PD-L1单抗Imfinzi(Durvalumab,商品名:英非凡)的上市申请(JXSS1800040/41)获得批准,用于治疗同步放化疗后未进展的不可切除III期非小细胞肺癌(NSCLC)。
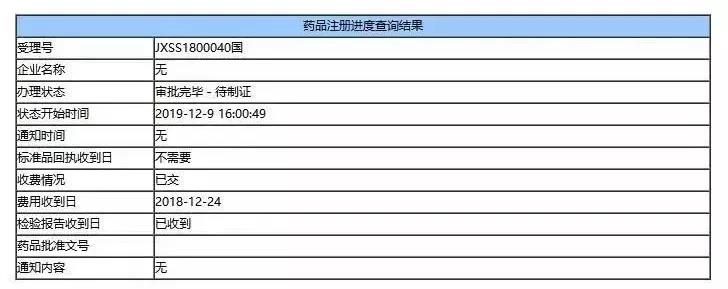
自此,I药成为国内获批的第一款PD-L1免疫检查点抑制剂。这也是继去年2月Imfinzi的这个适应症在美国获批后,短短的一年多后就可以登陆中国大陆。

本次获批基于代号为PACIFIC的临床研究。2017年9月,PACIFIC临床数据在线发表于医学顶级期刊《新英格兰医学杂志》。因为在无进展生存期(PFS)中Imfinzi取得的积极数据超过了很多专家的预期,PACIFIC研究也一直被学界称为“太平洋海啸”。

PACIFIC是一项随机、双盲、安慰剂对照的III期多中心临床试验,旨在评估Imfinzi在经含铂方案同步放化疗后未发生疾病进展的局部晚期非小细胞肺癌(NSCLC)患者中巩固治疗的疗效。
试验结果显示:I药联合放化疗试验组对比单独放化疗组:
(1)患者PFS延长了3倍,生存期延长时间近1年:17.2个月 VS 5.6个月,而且疾病进展或死亡的风险降低了48%;
(2)客观有效率(ORR)显著提高:30.0% VS 17.8%;
(3)不良反应未见显著增加,安全性良好:3-4级严重的不良反应,发生率为29.9%(安慰剂组为26.1%);
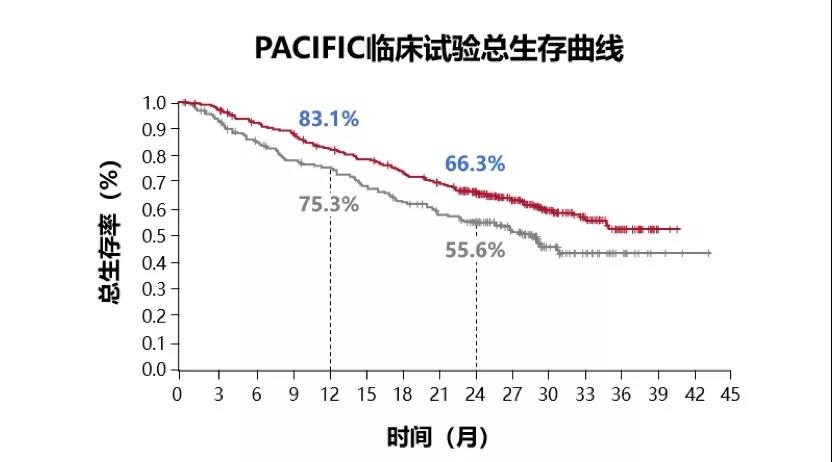
而在2019年ASCO会议上公布了最新的PACIFIC研究数据显示,Imfinzi组2年生存率超过66%,而对照组是不足56%;而3年生存率达到了57%,将来这部分获益者或者将会持续地从免疫治疗中获益。
PACIFIC是在过去的几十年里,Ⅲ期不可切除的非小细胞肺癌全身治疗中,第一个无进展生存期和总生存期都获得阳性结果的Ⅲ期临床研究,代表着该治疗领域的里程碑式进展。
2017年5月
美国FDA加速批准了Imfinzi用于局部晚期或转移性尿路上皮癌
2018年2月
FDA批准Imfinzi用于III期非小细胞肺癌(NSCLC)的患者,此前Imfinzi在NSCLC上适应症获得FDA授予突破性资格。
2018年12月
阿斯利康向中国递交Imfinzi的上市申请获得CDE承办受理。
2019年11月
FDA接受 Imfinzi适应症为先前未接受过治疗的广泛期小细胞肺癌(ES-SCLC)患者的补充生物制剂许可申请(sBLA),并授予该申请的优先审评资格。

因此,Imfinzi已在针对非小细胞肺癌、局限期小细胞肺癌、尿路上皮癌等适应症中多点开花,与此同时,还有多项研究正在进展中。
I药进入中国,为国内III期非小细胞肺癌患者提供了一个更好的选择。期待将来有更多适应症获批,造福广大的癌症患者。
常常去帮助,总是在安慰。康复之路易加医与您同行。如果您觉得这篇文章对您有帮助,欢迎关注易加医官网或下载易加医APP。易加医是专注于肿瘤领域的互联网医疗服务平台,为肿瘤患者和家属提供肿瘤预防、就医、诊疗、康复所需的各类服务。
易加医 2019.12.10



 浙公网安备 33010602004553号
浙公网安备 33010602004553号


