2020年元月16日,罗氏HER2-ADC药物注射用恩美曲妥珠单抗(T-DM1)在国内的上市申请(受理号:JXSS1900012/13)变更为"在审批",适应症为HER2阳性乳腺癌。T-DM1有望成为国内首个上市的ADC药物。
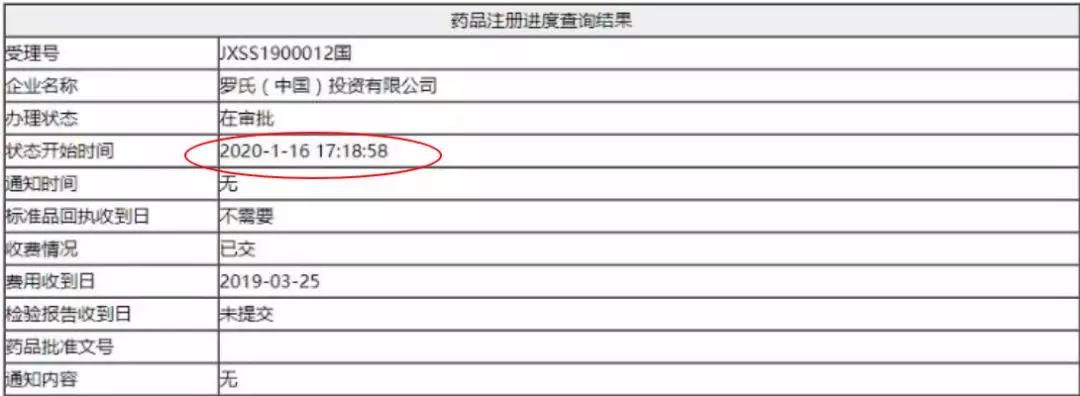
BOSS:TDM-1上市申请已经变为在审核了,快去发文章!
小编:老板,收到!
搜索适应症
搜索临床研究数据
写文
写文
发布啦!!
热心读者:好高兴,又有新药了!!
热心读者:小编小编,这个TDM-1什么时候上市?
小编:一般国内新药审批按流程需要几个月哦,请耐心等待!
技术审评科普
在《药品注册管理办法》中有规定,申报新药临床试验和生产的技术审评工作时间分别为90日、150日,若按工作日来计,分别约为4个月、7个月,其间,从完成国家药品评审中心审核提交药监局后大约需要2周的时间进行审批。
然而!!就在5天后的今天!
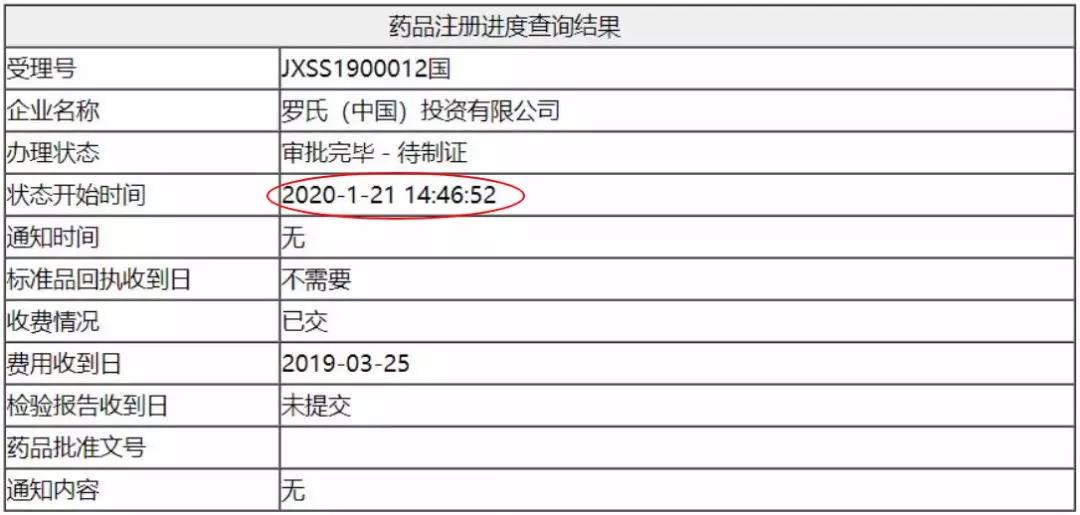
赫赛莱® 恩美曲妥珠单抗获批上市!
赫赛莱® 恩美曲妥珠单抗获批上市!
赫赛莱® 恩美曲妥珠单抗获批上市!

2020年元月22日,罗氏制药中国宣布,国家药品监督管理总局正式批准创新靶向药物赫赛莱®(英文商品名:Kadcyla®,通用名:恩美曲妥珠单抗),单药适用于接受了紫杉烷类联合曲妥珠单抗为基础的新辅助治疗后仍残存侵袭性病灶的HER2阳性早期乳腺癌患者的辅助治疗。
继FDA获批后8个月,欧盟获批后1个月,赫赛莱®(Kadcyla)就在中国获批了!不得不赞叹一声中国速度真牛!
这或许意味着肿瘤患者等待新药上市的时间将越来越短,这不得不说是送给广大肿瘤患者最好的新年礼物!
常常去帮助,总是在安慰。康复之路易加医与您同行。如果您觉得这篇文章对您有帮助,欢迎关注易加医官网或下载易加医APP。易加医是专注于肿瘤领域的互联网医患平台,为肿瘤患者和家属提供肿瘤预防、就医、诊疗、康复所需的各类服务。
易加医 2020.1.22



 浙公网安备 33010602004553号
浙公网安备 33010602004553号


