12月10日,罗氏制药宣布,国家药品监督管理局(NMPA)正式批准了帕捷特®(帕妥珠单抗)联合赫赛汀®(曲妥珠单抗)和多西他赛治疗尚未接受抗HER2治疗或化疗的HER2阳性转移性乳腺癌患者的一线标准治疗方案。这是近一年中帕捷特®在中国获批的第三大适应症。
“妥妥双靶联合多西他赛化疗”方案可以让HER2阳性晚期乳腺癌患者疾病恶化或死亡风险降低51%,并让患者平均总生存期延长40%至近5年,让晚期乳腺癌摆脱“绝症”成为了可能。

2018年12月
帕捷特®首个适应症在中国获批,联合赫赛汀®和化疗辅助治疗有高复发风险的 HER2 阳性早期乳腺癌患者,显著降低了高复发风险的HER2阳性早期乳腺癌患者的复发风险,标志着国内抗HER2治疗正式进入双靶时代。
2019年8月
NMPA批准了帕捷特®联合赫赛汀®和化疗,新辅助治疗局部晚期、炎性或早期的HER2阳性乳腺癌患者(直径>2cm或淋巴结阳性),作为早期乳腺癌整体治疗方案的一部分,为早期HER2阳性乳腺癌患者提供了全新的术前治疗选择。
2019年12月
帕捷特®一线治疗晚期HER2阳性乳腺癌患者的适应症在华获批。帕捷特®+赫赛汀®联合化疗治疗已经为患者构建起从起始的新辅助阶段到术后辅助、乃至晚期治疗中全程的HER2抑制管理,让越来越多乳腺癌患者获益,对我国乳腺癌的全流程规范化诊疗具有积极意义。
双靶方案改写治疗结局
晚期乳腺癌摆脱绝症成为可能
本次帕捷特®一线治疗HER2阳性晚期乳腺癌适应症的获批主要基于持续长达8年随访的CLEOPATRA研究和来自中国人群的PUFFIN研究两项研究结果。
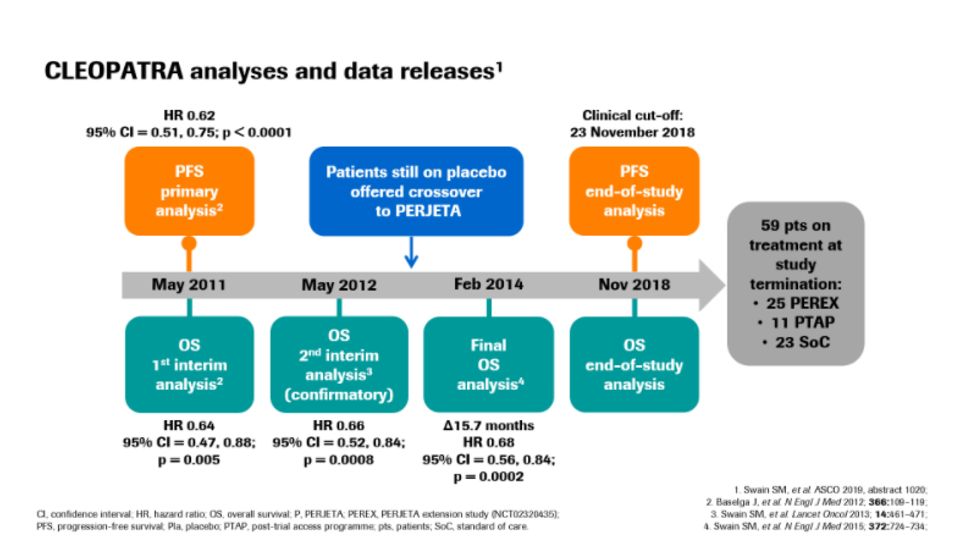
长达8年随访的CLEOPATRA研究
CLEOPATRA研究结果显示,“帕妥珠单抗+曲妥珠单抗联合多西他赛”可以使HER2阳性晚期乳腺癌患者无进展生存期(PFS)延长51%,达到18.7个月,患者总生存期(OS)延长40%,生存期可延长至近5年¹。
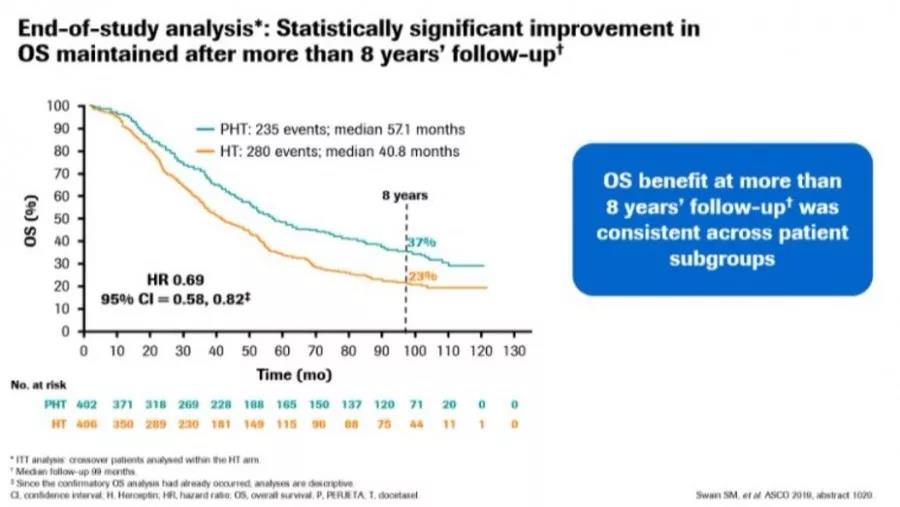
CLEOPATRA研究OS随访结果
随着研究随访时间的延长,在中位随访8年(最长随访10年)的时候,帕妥珠单抗+曲妥珠单抗联合多西他赛治疗组37%患者达到8年生存,显著高于曲妥珠单抗组的23%。

PUFFIN研究结果
作为CLEOPATRA的桥接研究,PUFFIN研究共入组243例HER2阳性晚期乳腺癌皆是中国患者,她们来自于全国15家临床中心,其研究结果和以往CLEOPATRA的研究结果相似。PUFFIN研究中的PFS获益趋势和全球数据是一致的²。
在11月底发布的2019年国家医保谈判药品名单上,“妥妥双靶”治疗方案中的赫赛汀®已成功通过医保谈判续签,且新增了新辅助治疗适应症;而帕捷特®也首次被列入《国家基本医疗保险、工伤保险和生育保险药品目录》,用于HER2阳性的局部晚期、炎性或早期乳腺癌患者的新辅助治疗和具有高复发风险HER2 阳性早期乳腺癌患者的辅助治疗。
对此,罗氏制药中国总裁周虹表示:帕捷特®进入中国的时间虽然晚于欧美市场,但一年当中三个适应症在中国全部获批,与欧美实现同步,这种世界一流的审批速度,显示了中国政府通过改革加速引入创新药物,不断提高中国人民健康水平的决心。
罗氏将继续秉承着‘先患者之需而行’的理念,在努力创新研发的基础上,把更多的创新产品带向市场,惠及更多中国乳腺癌患者。
在国家医保政策的庇护下,相信乳腺癌患者用药的可及性将得到大幅度改善,越来越多的乳腺癌患者能够接受到规范的“ 妥妥双靶治疗”,并从中获益。
参考文献
1. Swain SM, et al. ASCO.2019. abstract 1020
2. Binghe Xu, et al. 2019 ASCO. Abstract 1026
常常去帮助,总是在安慰。康复之路易加医与您同行。如果您觉得这篇肿瘤资讯对您有帮助,欢迎关注易加医官网或下载易加医APP。
易加医是专注于肿瘤领域的互联网医患平台,为肿瘤患者和家属提供肿瘤预防、就医、诊疗、康复所需的各类服务。
易加医 2019.12.11



 浙公网安备 33010602004553号
浙公网安备 33010602004553号


