4月10日, 阿斯利康和默沙东的PARP抑制剂奥拉帕利(olaparib)在乳腺癌的适应症被欧盟委员会批准,作为单药治疗生殖系BRCA1/2基因突变(gBRCAm),且人表皮生长因子受体2(HER2)阴性局部晚期或转移性乳腺癌患者,这是欧盟委员会针对该适应症批准的第一个PARP抑制剂。

欧盟此次批准适应症新增了2个额外的规定:
1、患者先前在(新)辅助治疗或转移性时接受过蒽环和紫杉类药物的治疗,除非患者被认为不适合这些治疗;
2、激素受体(HR)阳性乳腺癌患者在之前的内分泌治疗中和治疗后出现疾病进展,除非患者被认为不适合进行内分泌治疗。
本次批准是基于2017年6月已在《新英格兰医学杂志》上发表的OlympiAD研究相关的数据。

这是一项国际多中心、随机、开放性的3期试验,共纳入了302例患者BRCA突变的HER2阴性晚期乳腺癌患者,比较奥拉帕利和临床医师选择的化疗药物(卡培他滨、艾瑞布林或长春瑞滨)在疗效和安全性上的差异。
以2:1的比例将患者随机分组,奥拉帕尼(300 mg bid)组为205例,化疗组(卡培他滨、艾瑞布林或长春瑞滨)为97例。
研究结果显示,奥拉帕利组的患者较于化疗组的中位无进展生存期(PFS)延长了2.8个月(7.0个月 VS 4.2个月),且疾病进展风险显著降低42%(HR 0.58; 95%CI 0.43-0.80; P = 0.0009)。
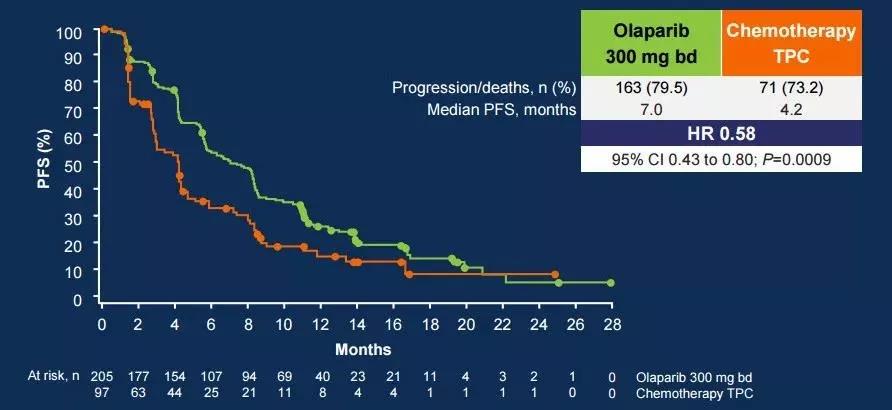
在可测量病灶的患者中,化疗组(n=66)的客观缓解率(ORR)仅为23%(95%CI 13-35),而奥利帕利组(n = 167)达到了52%(95%CI 44-60),是化疗组中患者的两倍多。
在不良反应方面,奥拉帕利治疗组中最常见的不良反应(≥20%)为:恶心(58%)、贫血(40%)、乏力(包括虚弱)(37%)、呕吐(30%)、中性粒细胞减少(27%)、呼吸道感染(27%)、白细胞减少(25%)、腹泻(21%)和头痛(20%)。
此外,患者对奥拉帕利耐受性较好,只有5%的患者因为药物毒性中止治疗,而化疗组为8%。
2018年1月,基于OlympiAD研究结果,美国FDA批准奥拉帕利用于治疗携带有害或疑似有害胚系BRCA基因突变(gBRCAm)的HER2为阴性的转移性乳腺癌。
2018年8月,奥拉帕利在国内获批上市,用于治疗卵巢癌,但还没有获批可以治疗乳腺癌。
本次欧盟批准奥拉帕利在乳腺癌的适应症无疑给BRCA突变的HER2阴性晚期乳腺癌患者带来了福音,希望国内能早日扩大适应症,让晚期HER2阴性乳腺癌患者在治疗上有更多的选择。
参考文献
LYNPARZA® (olaparib) Approved in EU for the Treatment of Germline BRCA-Mutated HER2-Negative Advanced Breast Cancer
常常去帮助,总是在安慰。康复之路易加医与您同行。欢迎咨询网站客服,加入易加医患友交流群,分享你的抗癌经历。患友之间互相鼓励,携手共进,共抗癌魔,易加医在行动!
易加医 2019.4.17



 浙公网安备 33010602004553号
浙公网安备 33010602004553号


