今日,英国制药巨头阿斯利康(AstraZeneca)在其官网宣布,美国食品药品监督管理局(FDA)批准Lynparza®(利普卓®,奥拉帕利)作为一线单药维持疗法,用于患有生殖系BRCA(Germline BRCA,gBRCA)突变的转移性胰腺癌的患者。这也是首个获批治疗胰腺癌的PARP抑制剂,具有里程碑意义。

本次批准是基于今年ASCO会议上公布的一项名为POLO的III期临床试验数据。早在今年2月份,阿斯利康与默沙东(Merck & Co)已经联合宣布,III 期POLO试验数据为阳性结果。
POLO是一项 III 期随机、双盲、安慰剂对照,Lynparza片剂(300mg,每日两次)作为单药维持治疗与安慰剂对比的多中心试验。
该试验随机分组了154名gBRCAm转移性胰腺癌的患者,这些患者在一线以铂为基础的化疗中没有发生疾病进展。患者随机接受(3:2)Lynparza或安慰剂治疗直至疾病进展。
主要研究终点是PFS,关键的次要研究终点包括总生存期,至第二次疾病进展时间,总体反应率,疾病控制率,以及与健康相关的生活质量。
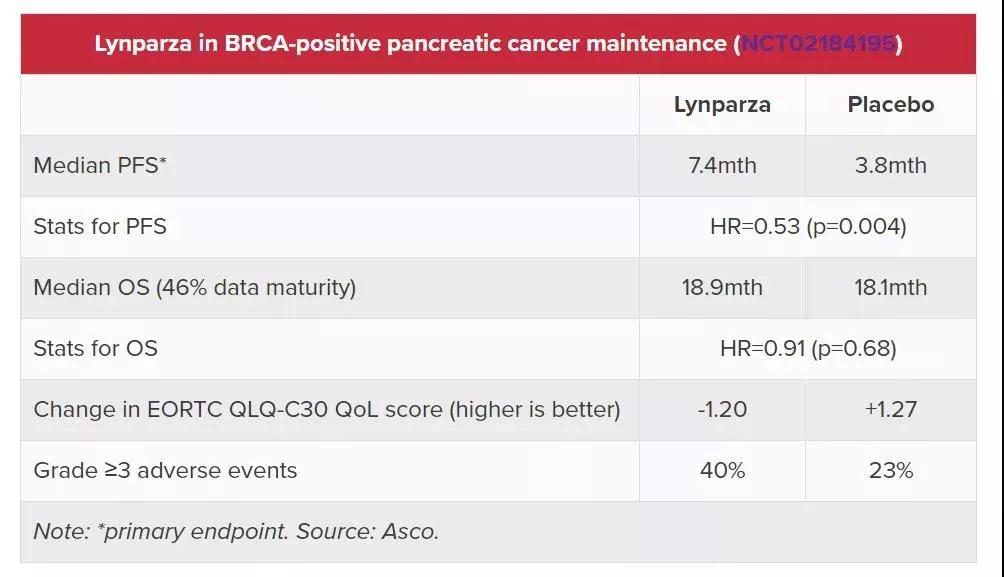
试验结果显示:与安慰剂组相比,
奥拉帕利组患者的中位无进展生存期(PFS)长达7.4个月(安慰剂组为3.8个月),几乎翻倍;
治疗2年后,奥拉帕利组有22.1%的患者未出现疾病进展,而安慰剂组仅有9.6%;
奥拉帕利组客观缓解率(ORR)为23.1%,而安慰组ORR仅有11.5%;
奥拉帕利组的中位缓解持续时间为24.9个月,而安慰剂组是3.7个月,仅为奥拉帕尼治疗组的1/6。
流行病学调查数据显示,我国每年胰腺癌新发9.5万左右,60%患者发现时已是晚期,发生了转移;而25%是局部晚期,失去了手术机会。因此,85%的患者在发现患病时已都不能手术,基本只能生存6~9个月。而其余15%的患者即使做了手术,预后也很差,几乎没有获益。
由于胰腺癌的强侵袭性和治疗手段有限,在过去几十年内,也没有突破性疗法问世,而奥拉帕利的出现,为艰辛的胰腺癌治疗之路带来了一线曙光。
作为首个口服多聚ADP核糖聚合酶(PARP)抑制剂,奥拉帕利通过抑制PARP酶活性和防止PARP与DNA解离,协同DNA损伤修复功能缺陷,杀死肿瘤细胞。“靶向阻断” 肿瘤细胞DNA修复路径,从 “源头” 上杀死癌细胞,达到靶向治疗的新药。
奥拉帕利已经被美国FDA批准用于治疗卵巢癌和乳腺癌。在中国,奥拉帕利也已经获批上市用于治疗卵巢癌,且在今年的11月底被纳入医保目录,药价降幅60%左右,大大降低了国内卵巢癌患者的经济负担,提高了药物的可及性,为更多的患者赢得了延长生命的机会。
目前奥拉帕利在胰腺癌治疗领域被批准是个历史性突破,为胰腺癌的患者治疗提供了更多的选择。期待奥拉帕利在中国能尽快获批胰腺癌的适应症,造福更多的癌症患者。
常常去帮助,总是在安慰。康复之路易加医与您同行。如果您觉得这篇肿瘤资讯对您有帮助,欢迎关注易加医官网或下载易加医APP。
易加医是专注于肿瘤领域的互联网医疗服务平台,为肿瘤患者和家属提供肿瘤预防、就医、诊疗、康复所需的各类医疗服务。



 浙公网安备 33010602004553号
浙公网安备 33010602004553号


