近年来,免疫治疗绝对是肿瘤治疗的爆炸性进展,随着PD-1/PD-L1抑制剂在多个瘤种中的应用,使得恶性肿瘤早期走向治愈,晚期走向慢性病化成为可能。但在肿瘤免疫治疗的进展中,PD-1/PD-L1抑制剂仅是沧海一粟,多种免疫治疗手段正全面获得进展,在未来可以更好更全面地为肿瘤患者带来新的契机。
治疗性抗肿瘤疫苗,针对老靶点的新技术
提起疫苗,普遍的印象就是通过接种获得对传染性疾病的预防,但在肿瘤领域,通过对治疗性疫苗的研发,使得人体能针对肿瘤细胞表达的特殊抗原进行重新的免疫激活,从而杀伤肿瘤细胞。源自古巴的CIMAvax疫苗就是类似的产物。
CIMAvax疫苗是针对表皮生长因子受体(EGFR)的治疗性疫苗。众所周知,EGFR是在健康细胞和肺癌细胞上发现的正常分子。它在一些肺癌患者中高度表达,并在一定比例的非小细胞肺癌患者中存在突变。针对突变患者,目前有多种EGFR-TKI类药物如特罗凯,易瑞沙等,并且针对罕见突变和耐药突变,二代药物和三代药物也展示出更好地疗效。
和靶向药物不同,CIMAvax疫苗是生物治疗的方式,通过激活免疫系统去针对EGFR高表达的肺癌细胞进行杀伤,从而遏制癌症并阻止其增长。
通俗点来说,由于正常细胞和癌细胞生长都需要一种重要的蛋白质--表皮生长因子(EGF),肺癌细胞生长也需要大量的表皮生长因子,这相当于是细胞生长的养料,当注射Cimavax肺癌疫苗后,会刺激机体产生大量的抗体,这样,体内的表皮生长因子就会与抗体特异性的结合而大量减少。
由于癌细胞存在基因成瘾性,对于EGF的需要要远高于正常细胞,对正常细胞可以通过其他途径获得耐受而继续生存,而依赖表皮生长因子的肺癌细胞只能出现死亡。相比之下,治疗性疫苗的不良反应也要小于化放疗等传统模式,仅为注射部位的疼痛,发烧,呕吐和头痛等轻微不良反应。
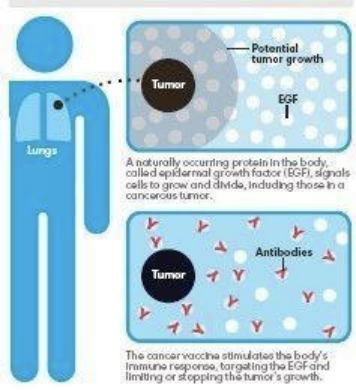
CIMAvax是针对称表皮生长因子(EGF)的疫苗
目前,已经有加拿大和美国晚期肺癌患者慕名前往古巴接受治疗,经疫苗治疗几个月后,部分患者肺部影像检查发现肿瘤竟然已经缩小了90%甚至完全消失,完全超出了所有人的想象,并且治疗过程完全没有出现化疗时的任何副作用。
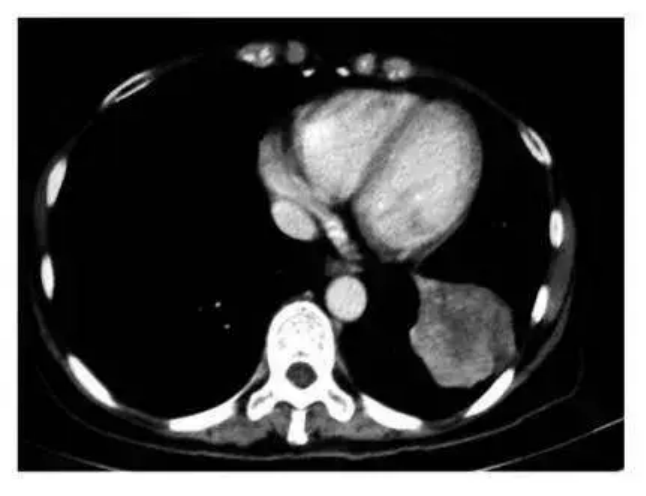
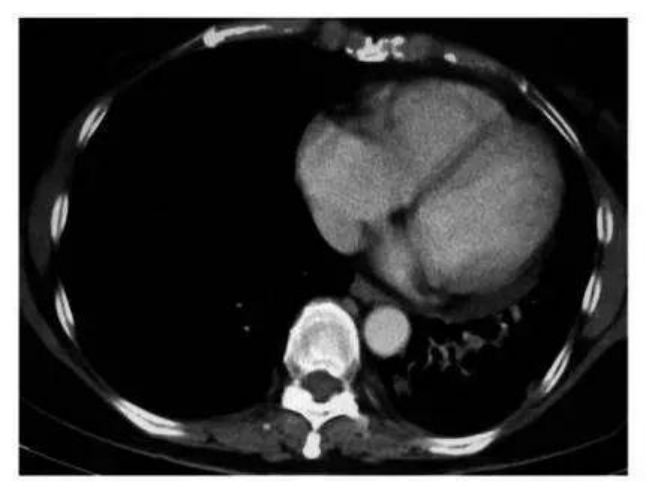
CIMAvax疫苗
在部分患者中有出色的疗效和低毒的安全性
2018年9月,世界肺癌大会上,第一次CIMAvax-EGF美国临床试验的初步结果表明,古巴开发的这种免疫疗法安全,耐受性好,值得进一步研究。目前二期临床试验和三期临床试验也正在顺利进行中。随着研究结果的披露,将掀起一场新的治疗革命。
CAR-T细胞免疫治疗,携带靶点的免疫细胞
传统的细胞免疫治疗疗法通过采集人体自身免疫细胞,经过体外培养,使其数量倍增,然后再回输到人体来杀灭血液及组织中的癌细胞,激活和增强机体的免疫能力的疗法,常见的有细胞因子诱导的杀伤细胞(CIK)疗法、树突状细胞(DC)疗法、API生物免疫治疗、DC+CIK细胞疗法、自然杀伤细胞(NK)疗法、DC-T细胞疗法等。但传统的细胞免疫治疗由于是非特异性免疫,很难解决肿瘤的免疫逃逸和免疫耐受等问题。
而CAR-T(嵌合抗原受体T细胞)疗法,是指通过基因修饰技术,将带有特异性抗原识别结构域及T细胞激活信号的遗传物质转入T细胞,使T细胞直接与肿瘤细胞表面的特异性抗原相结合而被激活,通过释放穿孔素、颗粒酶素B等直接杀伤肿瘤细胞,同时还通过释放细胞因子募集人体内源性免疫细胞杀伤肿瘤细胞,从而达到治疗肿瘤的目的,而且还可形成免疫记忆T细胞,从而获得特异性的抗肿瘤长效机制。相当于将肿瘤细胞的靶点应用于T细胞中,从而产生特异性免疫,产生靶向性的免疫治疗效果。
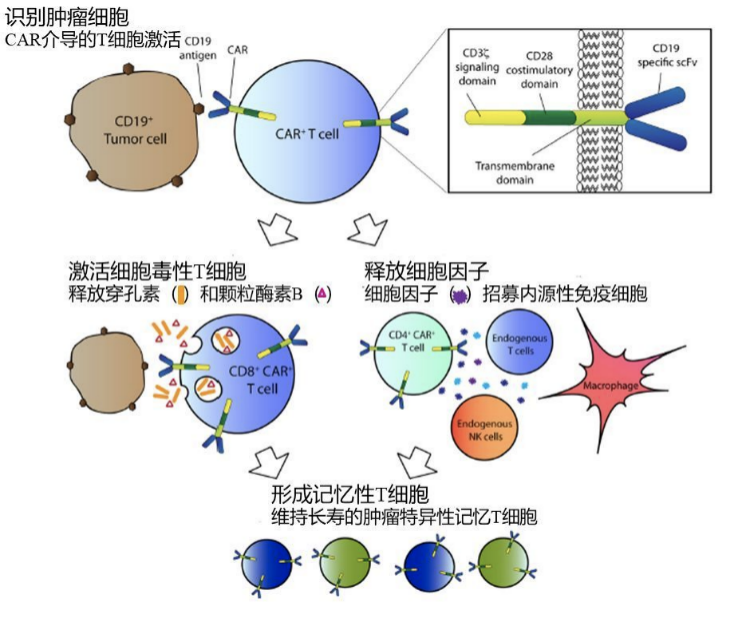
CAR-T细胞杀伤肿瘤细胞并获得免疫激活
目前有两款CAR-T产品获得FDA批准,集中在血液系统肿瘤中。首款是tisagenlecleucel。2017年批准用于治疗难治或至少接受二线方案治疗后复发的B细胞急性淋巴细胞白血病(B-ALL)。第二款是axicabtagene ciloleucel。2017年批准用于治疗其他疗法无效或既往至少接受过2种方案治疗后复发的特定类型的成人大B细胞淋巴瘤患者,包括弥漫性大B细胞淋巴瘤、转化型滤泡性淋巴瘤、原发纵隔B细胞淋巴瘤。
与血液系统肿瘤中的尚佳疗效不同,CAR-T细胞疗法在实体肿瘤的研究面临很多瓶颈。为了取得这一领域的进展,需要更科学地明确治疗目标,找到并优化实体瘤合适的抗原靶点,制定战胜肿瘤微环境的策略,找到更好的方法来保护T细胞免受免疫抑制。
溶瘤病毒,以毒攻毒的过程
溶瘤病毒的发现源自20世纪初,一位意大利的医生发现一位宫颈癌患者在感染狂犬病毒后肿瘤出现不断消退,因此,将该患者的肿瘤消退和狂犬病毒的感染联系起来。
针对这一现象,后续有大量科学家针对病毒的抗肿瘤作用进行研究。在1950至1980年间,溶瘤病毒的基础研究和临床实验是在曲折中不断成长,人们先后尝试将野生型病毒或者某些毒力自然降低的野生病毒包括肝炎病毒(hepatitis)、西尼罗河热病毒(West Nile fever)、黄热病毒(yellow fever)、登革热病毒(dengue fever)和腺病毒(adenoviruses)应用于肿瘤治疗中。
由于当时的分子生物学技术受限,无法对病毒进行改造,从而无法控制病毒的毒力和对肿瘤细胞的靶向性,因此无法明确溶瘤病毒的疗效和安全性。
随着分子生物学技术的进步和基础研究的进展,科学家发现有效的溶瘤病毒需要满足:
1. 通过病毒特异性受体介导的机制进入肿瘤细胞;
2. 在快速分裂的肿瘤细胞中高速复制;
3. 在肿瘤微环境中通过病毒复制促进先天免疫和适应性免疫激活。
溶瘤病毒促使肿瘤细胞死亡并激活自身免疫
因此,在基础研究获得突破后,多项临床研究开展并获得初步成功。1998年美国基于HSV-1再次深度开发为G207试用于恶性神经胶质瘤I期临床试验,再到2009年日本基于HSV-1开发的第三代溶瘤病毒G47Delta开展针对胶质母细胞瘤的I 期临床试验。
后续2015年被美国食品药品监督局(U.S. Food and Drug Administration, U.S. FDA)批准美国安进(Amgen)公司上市的基于HSV-1(1型单纯疱疹)病毒基因改造产品 T-VEC(talimogene laherparepvec)(随后被欧盟批准上市),是第一个获批应用于临床的靶向黑色素实体瘤治疗的溶瘤病毒,可明显延长患者的总生存期,这标志着溶瘤病毒治疗已经走向成熟。
同样,国内在溶瘤病毒开发过程中也有突破, H101(Uncorine / Oncorine,中文名安柯瑞),其由2005年经中国食品药品监督管理局(China Food and Drug Administration, CFDA)批准上市的全球首个用于治疗经常规放疗或化疗加放疗无效,并以5-FU、顺铂化疗方案进行姑息治疗的晚期鼻咽癌患者的溶瘤病毒制剂,在重组5型腺病毒颗粒的基础上删除E1B-55 KD和E3区基因片段78.3 – 85.8 mu获得。
后续研究发现,该种溶瘤病毒还可以治疗肝癌、胰腺癌、恶性胸腹腔积液和宫颈癌等。目前,该溶瘤病毒已经历多项临床研究,通过后续更严谨的临床研究设计和实施,将在不久的未来应用于临床。总的来说,溶瘤病毒是目前免疫治疗重要的方式,但目前仅有极少数瘤种可以应用,相关临床研究正在进行中,期待后续的进一步推广验证。
溶瘤病毒联合CAR-T细胞免疫治疗,为肿瘤细胞标定靶点的新型免疫疗法
细胞免疫治疗一直是免疫治疗的重要组成部分,目前有NK-T细胞治疗,CAR-T治疗等多种方式。特别是CAR-T细胞治疗,在血液系统肿瘤如某些白血病中已经展示出治愈性的效果,并且已获得美国食品和药物管理局的批准。在肺癌等实体瘤中,如何寻找靶点一直是治疗的难题。
而在一项新的研究中,美国希望之城国家医疗中心的科学家结合了两种免疫疗法——溶瘤病毒和嵌合抗原受体(CAR)T细胞疗法,克服了肿瘤微环境的影响,成功靶向且根除了原本难以仅用CAR T疗法治疗的实体瘤。该研究于9月2日作为封面文章发表在《科学转化医学》(Science Translational Medicine),该项研究的进展为实体瘤治疗特别是耐药性实体瘤治疗注入了新的动力。

溶瘤病毒(OVm19t,绿色)联合CAR T细胞治疗法
登上《科学转化医学》封面
既往研究发现,溶瘤病毒是有效的肿瘤治疗方法,与CAR-T细胞疗法进行组合后,可以更有效地靶向实体瘤,从而避免肿瘤本身带有的免疫抑制对CAR-T细胞治疗的影响。
由于实体瘤表面存在免疫抑制肿瘤微环境,CAR-T无法突破这种微环境屏障,有效地发挥作用,但是溶瘤病毒能够突破这一障碍。利用了这一点,研究人员设计一种溶瘤病毒使它能进入癌细胞,利用细胞自身的机制进行自我复制,并使癌细胞表面表达一种众所周知的CAR-T细胞靶点CD19的截短形式。使得CAR-T细胞有效识别肿瘤细胞并突破免疫抑制微环境,彻底杀伤肿瘤细胞。

工程化溶瘤病毒(OVm19t,绿色)散布在小鼠结直肠癌细胞中,表达CD19后,这些细胞被携带CD19的CAR T细胞杀灭
基础研究发现,当使用溶瘤病毒感染肿瘤细胞时,CD19t被肿瘤细胞表达的时间比病毒杀死它们的时间要快得多,使得CD19-CAR T细胞靶向有很好的治疗窗口发挥疗效。并且接受治疗后,已经用溶瘤病毒和CAR T细胞联合治疗的小鼠显示出长期的抗肿瘤免疫保护作用,这意味着在临床实践中,该治疗方法可以有效地预防肿瘤的反弹和复发。
因此,通过一个简单的概念的转化实践,联合治疗带来了新的靶向作用,使得细胞免疫治疗在实体瘤治疗中成为可能,后续,相关临床试验将首先测试新型溶瘤病毒在实体瘤患者中的安全性。后续在开展联合治疗的临床试验,该试验预计于2022年开始。介时,将有更多患者可以从联合治疗中获益。
从前面的相关研究可以看出,目前免疫治疗绝不仅仅只是PD-1/PD-L1的天下,未来将有更多的治疗模式,更精准优效低毒的药物,为肿瘤患者带来新的治疗契机。
作者简介

陈佳琦
医学博士(M.D.) 副主任医师
浙江大学医学院附属第二医院肿瘤内科
毕业于北京协和医学院八年制
中国抗癌协会整合肿瘤学分会青年委员
浙江省抗癌协会大肠癌青年委员会秘书
中国医药卫生文化协会
全民健康素养促进分会青年委员
下载易加医APP,在线咨询陈佳琦医生
就医之路感到迷茫?
我们也许能帮到你!
易加医目前有多种癌症病友群
就医服务/第二意见/病友交流
欢迎咨询网站客服、申请入群



 浙公网安备 33010602004553号
浙公网安备 33010602004553号


